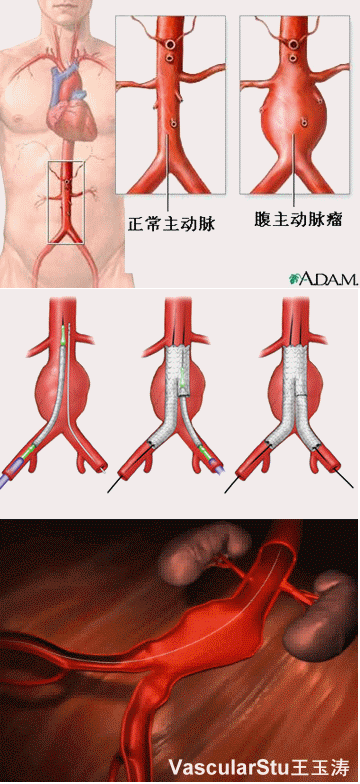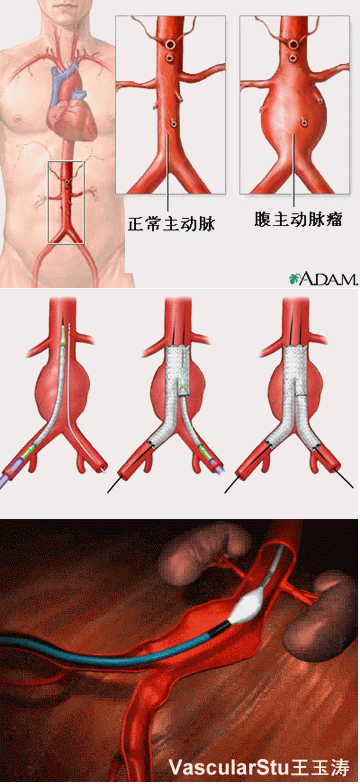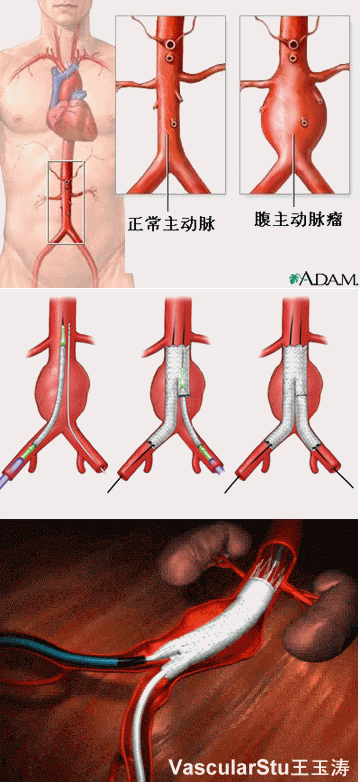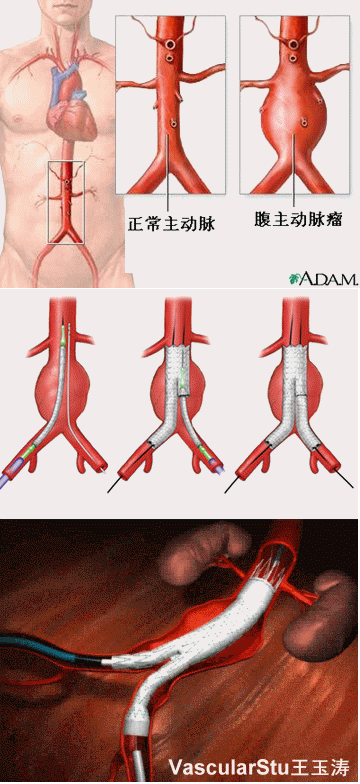
1、严重烧伤后微血管内皮细胞氧自由基产生增加,组织对氧自由基清除能力降低,细胞内钙越载,溶酶体蛋白酶释放,内皮素等细胞因子的释放,以及白细胞与内皮细胞的黏附性增强等因素均参与了烧伤休克延迟复苏造成重要脏器损伤。休克使各重要脏器细胞在遭受缺血性损伤的同时,产生和具备了造成再灌注损伤的细胞分子生物学基础。
2、延迟复苏使氧自由基的产生进一步增加:当组织灌注不良时,细胞出现能量代谢障碍,ATP生成减少、AMP的再利用障碍造成累积,AMP进一步降解为次黄嘌呤并溢出细胞膜进入细胞间隙。当组织血流恢复,供氧充分时,组织中广泛存在的黄嘌呤氧化酶(XO)以O2替代NAD+为受电子体,与细胞间累积的次黄嘌呤反应,生成大量活性氧。
氧自由基的另一来源是扣留于脏器组织的中性粒细胞,其与内皮细胞黏附并被激活,通过呼吸爆破产生活性氧(由NADPH氧化酶催化产生)。氧自由基主要造成细胞膜及细胞器(如线粒体)膜脂质过氧化损伤,线粒体的损伤又进一步加重能量代谢障碍,形成恶性循环。
3、细胞内钙超载:细胞能量代谢障碍引起Na+-K+-ATP酶活性降低,细胞内Na+浓度增加,进而刺激Na+-Ca+交换增加;氧自由基对细胞膜结构的损伤使通透性增加,血浆Ca+沿钙离子的跨膜梯度流向并积聚,胞浆内增高的Ca+浓度又刺激内质网释放Ca+,由此造成细胞内钙超载。
烧伤后L型钙通道、内质网Ryanodine受体系统的功能紊乱也促成了细胞内钙超载。Ca+作为细胞内第二信使参与信号转导。钙超载导致细胞操作和功能障碍。
4、磷脂酶A2(PLA2)激活:氧自由基增多与细胞内钙超载协同作用,激活PLA2。活化的PLA2作用于细胞膜磷脂,通过花生四烯酸级联反应,生成前列腺素、白三烯、血栓素等炎症介质;线粒体膜的过氧化损伤可导致氧化磷酸化失偶联;PLA2还通过诱导血小板激活因子在细胞表面的表达,促进中性粒细胞黏附内皮细胞、浸润靶器官。
5、蛋白酶激活释放:缺血缺氧导致细胞溶酶体膜损伤,再灌注则促进溶酶体蛋白酶的释放和扩散。再灌注损伤后,细胞溶酶体及非溶酶体酶被激活释放;中性粒细胞在组织中激活后脱颗粒,释放其中的消化酶,由此造成组织中蛋白酶活性增高。
6、脏器组织中中性粒细胞聚集、NO含量减少,NO具有保护、损伤细胞的双重作用,取决于NO的浓度和激活不同的信号传导通路。倪俊、于宝军等人的实验证实:烧伤延迟复苏组织器官中PMN标志酶MPO活性明显增高,NO产生显著降低,组织含水量明显增高,据此认为NO减少促进PMN黏附于内皮细胞,浸润组织并释放活性氧、蛋白酶、细胞因子。延迟复苏时黏附分子的表达增高也是PMN聚集的主要因素。
7、细胞膜结构损伤以及细胞内钠、磷、镁、氯等离子代谢紊乱又为再灌流条件下细胞水肿和细胞内钙离子超负荷创造了条件。在延迟复苏开始后,随着组织灌流状态的改善,一系列与氧代谢和离子代谢有关的病理过程被启动,进一步造成细胞损伤。因此,单纯扩容的策略对烧伤休克延迟复苏是不利的。
8、实验研究还表明:烧伤休克延迟复苏所造成的重要脏器和组织损伤是通过多种途径,损伤因素具有组织器官特异性,即在不同的组织和器官中,主要的损伤因素可能不同;而在同一脏器或组织中,可能有多种因素参与再灌注损伤,其中某一因素处优势地位。
用药物(氧自由基清除剂、蛋白酶抑制剂和钙离子通道阻断剂)阻断不同的损伤途径后所进行的观察也证实了损伤因素的多重性和组织器官特异性,提示防治烧伤休克延迟复苏造成的再灌注损伤必须采取综合性措施。
例如,与延迟复苏同步给予氧自由基清除剂可有效减轻肺组织的细胞水肿;给予溶酶体蛋白酶抑制剂可有效防治心脏和肾脏的细胞能量代谢紊乱,而在防治小肠黏膜能量代谢紊乱和减轻小肠黏膜水肿方面,氧自由基清除剂和溶酶体蛋白酶抑制剂均显示有良好效果。