新药审批加速 国产创新药步入收获期
新闻简介:2018年上半年,FDA批准了17款新药,这其中有12个药物都是全球首批,其余的大多为欧盟首批。
国产创新药逐步迈入成果密集收获期
2018年上半年,FDA批准了17款新药,这其中有12个药物都是全球首批,其余的大多为欧盟首批。至于治疗领域分布方面,抗癌药热度未减,共有7个产品:分别是首次获批的杨森的Erleada和诺华的Lutathera,以及扩大适应症的杨森的ZYTIGA、阿斯利康的Imfinzi、礼来的Verzenio、安进的Blincyto、Seattle Genetics的Adcetris。
表1. 2018上半年FDA批准的17个新药
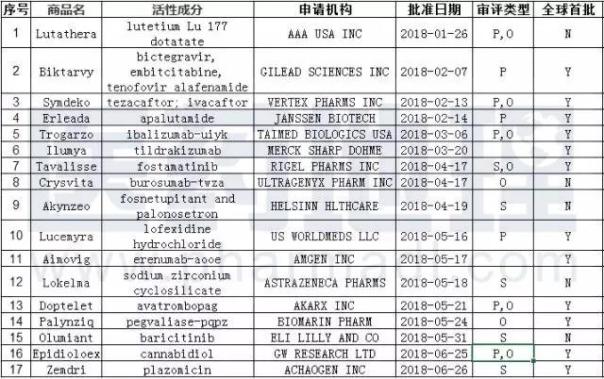
数据来源:中国新药研发监测数据库CPM & FDA,Novel Drug approvals for 2018
2017年,一大波进口和国产新药借助优先审评快速获批上市,一些幸运者还赶上了部分省市医保谈判的班车。聚焦国内市场,2018年上半年有二十多个新药品种依次上市。除了诺华、默沙东、葛兰素史克、礼来、拜耳等制药巨头外,国内企业不断积累国际竞争实力,国产创新药迎来大爆发,总计7个产品拿到上市许可。相比之下,2017年全年不过一个国产创新药获准上市(埃博拉病毒疫苗)。
表2. 2018上半年国内批准国产上市新药

数据来源:中国新药研发监测数据库CPM
表3. 2018上半年国内批准进口上市新药
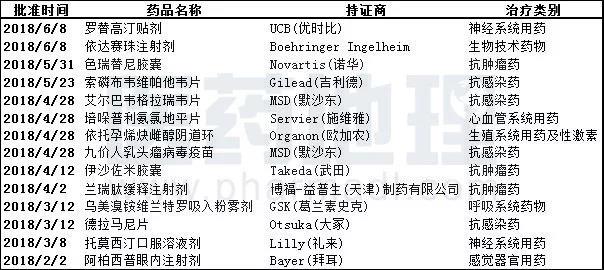
数据来源:中国新药研发监测数据库CPM
新药审批加速,国产创新药申报热度仍然持续走高
在2018年首次进入申报上市阶段的品种中,创新药整体增长态势远远优于改良型新药和生物仿制药。申报上市新药仍以进口药为主,但国产创新药方面也不乏亮点,比如两款国产PD-1/PD-L1单抗卡瑞利珠单抗和特瑞普利单抗紧随进口同类产品相继报产。从目前审评审批进度来看,预计2018年下半年还将会有大批品种通过优先审评快速上市,相应企业将优先享受产品增量的行业红利。
我们从批准上市及申报上市的品种中可以看到,外资创新药正加速进入中国市场,给国内企业带来挑战同时也给国内企业从海外引入品种带来了较好的契机。此前,大量的国外上市创新药受制于审评速度,国内的上市时间往往晚于国外数年之久,新药进入中国严重滞后,导致许多患者失去最佳治疗时间窗口,也影响到企业研发创新的动力与效率。
表4. 2018上半年首次申报上市的国产新药
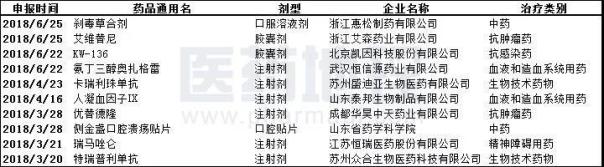
数据来源:中国新药研发监测数据库CPM
表5. 2018上半年首次申报上市的进口新药

数据来源:中国新药研发监测数据库CPM
纵览2018上半年国内新药申报情况——
中国自主研发抗体新药新时代即将到来,单抗类生物药迎来发展春天
国内外PD-1研发进度较快的公司前后申报上市,意味着国内抗肿瘤市场即将迎来免疫药物治疗时代。PD-1/L1单抗药物作为肿瘤免疫治疗的明星药物,未来更有望成为绝大多数肿瘤治疗中的基石性药物,有望占据抗肿瘤药物市场超过1/6的份额,初步估算市场空间超过400亿元。而随着适应症的进一步拓展,获批适应症走向更前线治疗,以及联合疗法对肿瘤患者生存时间的进一步改善,市场空间有望得到进一步的提升。
1、苏州盛迪亚 注射用卡瑞利珠单抗
注射用卡瑞利珠单抗是人源化抗 PD-1单克隆抗体,可与人PD-1受体结合并阻断PD-1/PD-L1通路,恢复机体的抗肿瘤免疫力,从而形成癌症免疫治疗基础。适用于既往接受过至少二线系统性治疗(含自体造血干细胞移植)的复发/难治性经典型霍奇金淋巴瘤患者的治疗。经查询,目前国内暂无同类产品获批上市,国外已上市的同类产品有默沙东公司的Keytruda(通用名:Pembrolizumab))和百时美施贵宝公司的Opdivo(通用名:Nivolumab),均于2014年获FDA批准上市。除恒瑞医药外,国内另有信达生物、君实生物、百时美施贵宝、默沙东等企业提交了同类产品的国内上市申请。
2、葛兰素史克 注射用贝利尤单抗
2011年3月9日美国FDA批准一新型生物制剂——贝利单抗(Benlysta)上市,成为该局近56年来首次批准治疗红斑狼疮的新药。贝利单抗可与B淋巴细胞刺激因子(B-lymphocyte stimulator,BLyS)结合并产生抑制作用,进而使制造体内抗体的B细胞自我毁灭,减缓免疫系统对自体组织的攻击,适用于治疗正在接受标准治疗的有活动性、自身抗体阳性、全身性红斑狼疮成年患者。
新一批优先审评药品注册申请名单公布,上市公司葛兰素史克产品注射用贝利尤单抗以与现有治疗手段相比具有明显治疗优势理由入选其中。
3、优时比 注射用培塞利珠单抗
优时比首次在国内提交培塞利珠单抗注射液的进口上市申请,已获CDE承办,受理号JXSS1800003,公司有5个进口新药申请以“具有明显临床价值,重大专项”的理由被CDE纳入优先审评,其中就包括一个生物制品(培塞利珠单抗注射液)和四个化药(拉考沙胺片)。
4、众合生物 注射用特瑞普利单抗
特瑞普利单抗(JS001)是国内第4个提交上市申请的PD-1/PD-L1类药物,也是第一家获得CDE(药品审评中心)受理的国内企业。 BMS的nivolumab已经在2017/11/2申报上市,用于二线治疗非小细胞肺癌,并获得了优先审评。信达生物的信迪单抗在2017/12/13提交上市申请,用于治疗霍奇金淋巴瘤。默沙东的帕博利珠单抗在2018/2/11提交了上市申请。
5、默沙东 注射用帕博利珠单抗
Keytruda目前优势最大的适应症是肺癌,不仅联合化疗作为一线疗法可以不考虑患者PD-L1表达水平,而且率先在临床试验中做出了OS优势。2017年默沙东Keytruda的全球销售额是38.09亿美元,距离百时美施贵宝Opdivo的差距已经缩小到11亿美元。
Keytruda的强势表现还在于2017年5月被FDA批准用于治疗携带高度微卫星不稳定性(MSI-H)或者错配修复缺陷(dMMR)的实体瘤患者,成为首款不是基于肿瘤发病位置而是基于肿瘤标记物的癌症治疗方法,在癌症史上具有划时代的意义,同时适用人群也显著扩大。
6、罗氏 注射用帕妥珠单抗
一种单克隆抗体。它是第一个被称作“HER二聚化抑制剂”的单克隆抗体。通过结合HER2,阻滞了HER2与其它HER受体的杂二聚,从而减缓了肿瘤的生长。Perjeta在2012年6月通过了美国FDA的认证,被批准与赫赛汀(trastuzumab,曲妥珠单抗)和紫杉醇(docetaxel)联合使用,用于HER2阳性,乳腺癌已经扩散到身体不同部位(转移性)并且没有接受过抗HER2治疗或化疗的转移性乳腺癌患者。对于早期HER2阳性乳腺癌患者,曲妥珠单抗+帕妥珠单抗+化疗已成为其全程疗法,进一步巩固了罗氏在HER2阳性乳腺癌治疗领域的王者地位。帕妥珠单抗在中国上市后,有望为中国患者提供治疗新选择。