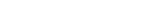细胞趋化因子(ECF-A),因此在虫卵周围出现以淋巴细胞、巨噬细胞、嗜酸性粒细胞浸润为主的肉芽肿。
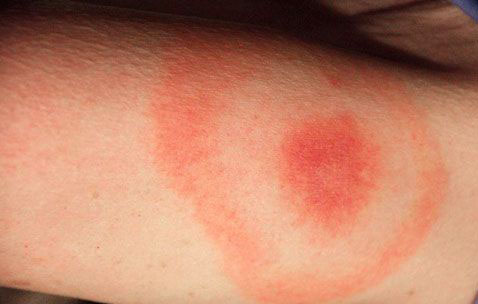
在寄生虫感染中,有的寄生虫病可同时存在多型变态反应,病理后果是多种免疫病理机制的复合效应,甚为复杂多变。如前已述及,血吸虫感染时引起的尾蚴性皮炎(属I型和IV型变态反应)、对童虫杀伤的ADCC作用(属Ⅱ型变态反应)、血吸虫性肾小球肾炎(属Ⅲ型变态反应)以及血吸虫虫卵性肉芽肿(属IV型变态反应)。又如由昆虫引起的变态反应,主要是速发型和迟发型,部分是免疫复合物型。当昆虫叮咬时它的分泌物、排泄物以及毒毛等(过敏原)侵入人体而诱发局部的和全身的变态反应现象。
寄生虫感染所致的变态反应疾病归纳如下(表17—1)。
分型 免疫成分 损伤机制 寄生虫感染举例
I IgE 肥大细胞,嗜碱性粒细胞及其介质 血吸虫尾蚴蚴性皮炎,热带肺嗜酸性粒细胞增多症,包虫囊破裂所致的休克
Ⅱ IgM,IgG 补体活化,白细胞趋化、活化,NK细胞作用 疟疾(三日疟)的贫血,恰加斯病心肌炎
Ⅲ CAg 补体活化,白细胞趋化、活化 疟疾(三日疟)肾病综合征,急性血吸虫病
IV CD8+T细胞CD4+T细胞 直接致靶细胞溶解,活化吞噬细胞、细胞因子释放导致炎症 皮肤利什曼病,血吸虫尾蚴性皮炎、肝硬化,丝虫性象皮肿
17.2 举例
以下仅举几例以介绍寄生虫病与变态反应之间的关系
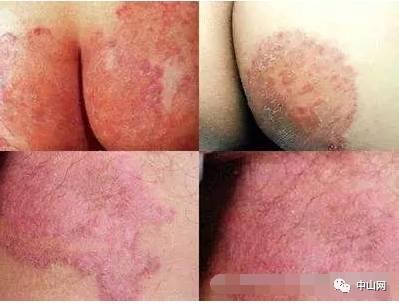
17.2.1 疥螨
疥螨在进食的吸吮过程中,向皮肤内分泌唾液,其唾液中或者用来叮咬的口器中含有的抗原诱发免疫应答。
I型变态反应:疥螨在皮肤上掘隧道时抗原即被导入,这些抗原通过表皮向下扩散;针对疥螨特异性抗原的IgE循环,渗入真皮,其Fc段接触肥大细胞的Fc受体;当疥螨抗原同肥大细胞表面的特异性IgE相遇并互相作用,导致脱颗粒,引起血管扩张和血浆漏出。IgE或I型反应可能参与疥疮的发病机制,其证据有:①患者的IgE水平升高;②经有效的治疗后IgE即下降;③皮内注射成熟雌疥螨浸出物可使以前患过疥疮者发生风团反应,而健康志愿者则否;④该反应可通过一种血清因子而被动转移;⑤结痂性疥疮血清在体外可致组胺的释放和嗜碱粒细胞的脱颗粒;⑥结痂性疥疮血清IgE明显升高;⑦用粗制疥螨抗原进行放射免疫吸附试验显示血清中抗原特异性IgE升高;⑧针对疥螨的IgE抗体能与一种普通的屋尘螨(dermatophagoides pteronssinus)的抗原发生交叉反应。
Ⅱ型变态反应:由IgG或IgM结合抗原而产生。常由补体及吞噬细胞介导。当补体存在时,正常人血清能否直接杀伤疥螨,尚无关键性研究来证实。某些疥疮患者血清IgG与IgM升高,但与皮损范围、严重程度或病期并不相关。然而,在有效的治疗后可下降。这些高水平的IgG和IgM是抗原特异性的,还是非特异性的,抑或是否与伴发的脓皮性细菌感染有关,还不清楚。有时患者血清IgA下降,治疗后即升高,其降低的原因不明。
补体C3、C4一般正常,但并不意味着补体不被激活。直接免疫荧光检查发现患部皮肤的表皮真皮连接处有IgM和C3沉积,提示来自疥螨的抗原向下弥散,来自真皮血管的抗体向上弥散,二者发生反应。然而,IgM和C3的沉积也可见于其它许多不同原因的炎症性皮肤病。因此,关于疥疮表皮真皮连接处免疫反应物的意义仅属推测性的,沉积有可能继发于炎症。
Ⅲ型变态反应:在预先致敏的宿主,皮内注射抗原可以实验性诱发Arthus反应。疥疮患者可能有针对疥螨各种抗原的IgG或IgM抗体。如通过搔抓或其它机制抗原进入真皮,而同时宿主有适量IgG和IgM抗体的话,那么在理论上则可能发生局部Arthus反应。循环免疫复合物沉积于皮肤小静脉也能引起血管炎。这些复合物激活补体导致吞噬细胞浸润血管壁,从而引起血管坏死。
在治疗前后的结痂性疥疮与普通疥疮患者血清中已发现由疥螨抗原及抗体组成的免疫复合物。复合物中抗原的性质尚不明确,疥疮感染可引起全身性皮肤血管炎,活检标本已发现血管炎伴有血管壁坏死。疥疮的丘疹、结节和隧道处的血管壁可有C3、IgM及IgA沉积。在成熟或未成熟疥螨附近可发生表皮坏死。虽然丘疹发生的溃烂多数是由于搔抓所引起的,但有些可能是由于局部Arthus反应及伴发的坏死性炎症所致。
Ⅳ型变态反应:Mellanby将疥螨接种于健康的志愿者。第一个月,受试者无症状,搔痒性丘疹往往在初次接种后一个月或更长时间才出现;第二次接种时,症状及体征迅速出现,没有初次接种那样长的潜伏时间,这提示疥疮的症状及体征是免疫应答导致的,属典型的由T淋巴细胞介导的迟发性超敏反应。疥疮是由人疥螨感染皮肤导致的,在缺乏免疫反应时,疥螨本身导致的症状极少。当机体对其产生免疫应答时,患者出现丘疹、风团、结节及结痂性丘疹,这些损害是机体对疥螨抗原发生迟发性超敏反应的结果。红斑、风团及极少发生的血管炎可能是由IgE或(和)IgM及IgG参与的体液免疫所致。
17.2.2 溶组织内阿米巴(Entamoeba histolytica)(以下简称阿米巴)
它可引起肠阿米巴病或肠外阿米巴病(主要是阿米巴肝脓肿)。在阿米巴肝脓肿(amoebic liver abscess,ALA)时细胞免疫抗阿米巴的机制简述如下。有人指出,细胞免疫在肝肠之间构成一个免疫学屏障(immunological barrier),如果这种屏障破坏,则可导致ALA的发生。那么这种屏障是如何发挥作用的呢?很多资料表明巨噬细胞、淋巴细胞在这种屏障中发挥着重要的作用。Chugh(1985)和Saxena(1966)观察到单个核细胞(mononuclear cell,MNC)及腹腔巨噬细胞与滋养体之间有直接接触。效应细胞先是连接到滋养体上,然后又从死亡的滋养体游走开来,证明杀阿米巴滋养体的为ADCC,且一个效应细胞能杀伤多个靶细胞。ADCC不需要补体的参与,但需要低浓度的抗体共同作用。抗体通过Fc段连接到效应细胞上,再经Fab段与靶细胞连接,这样可把大量的效应细胞连接到滋养体上,通常是完全包绕滋养体,从而使滋养体变形、解体,然后,效应细胞又可在抗体参与下杀伤其它滋养体。Chadee等(1985)用感染阿米巴的沙鼠的腹腔巨噬细胞及淋巴细胞(来源于肠系膜淋巴结)进行体外研究,也证明效应细胞对滋养体的杀伤系ADCC。参与阿米巴滋养体的ADCC的效应细胞,文献报告最多的是巨噬细胞,其次是淋巴细胞、细胞毒T细胞和K细胞,而Chugh认为是单核细胞。参与的抗体为IgG。Saxena用2—巯基乙醇处理脉鼠抗阿米巴血清(破坏IgM),对效应细胞抗阿米巴的能力无影响。纯化的IgM不能引起ADCC,故认为参与的抗体为IgG。同时,在实验中,经Sephadex G—200过柱的阿米巴抗原中,用其组分I免疫动物(MW650000)所产生的免疫血清,IgG滴度最高。
17.2.3 隐孢子虫
感染人类引起隐孢于虫病的病原为微小隐孢子虫(Crypt